鄭州源創基因科技有限公司成立于2016年,由哥倫比亞大學博士后趙輝,歸國創辦的國家高新技術企業。擁有97項知識產權及實用技術,業務遍布上海、重慶、深圳、北京等城市,總部在鄭州航空港區。
01心臟病,威脅健康的最大“殺手”
根據世界衛生組織(WHO)的數據,心血管疾病每年導致約1700萬人死亡,是全球最大的死亡原因。換句話說,每34秒就有一人因心臟病或中風而失去生命。這一數據讓人警醒,心臟問題,需要我們每一個人密切關注。
心臟病包括諸多種疾病,比如說我們常見的高血壓、冠心心功能不全,以及瓣膜病、心肌炎、心肌病等等,都屬于心臟病造成的影響。心臟有泵血功能,當累及血管狹窄的時候,使得心臟的供血出現問題,就表現為心絞痛、心肌梗死。
近年來,心臟病日趨年輕化,有數據顯示,約三分之一的心臟病患者年齡在35歲到64歲之間。
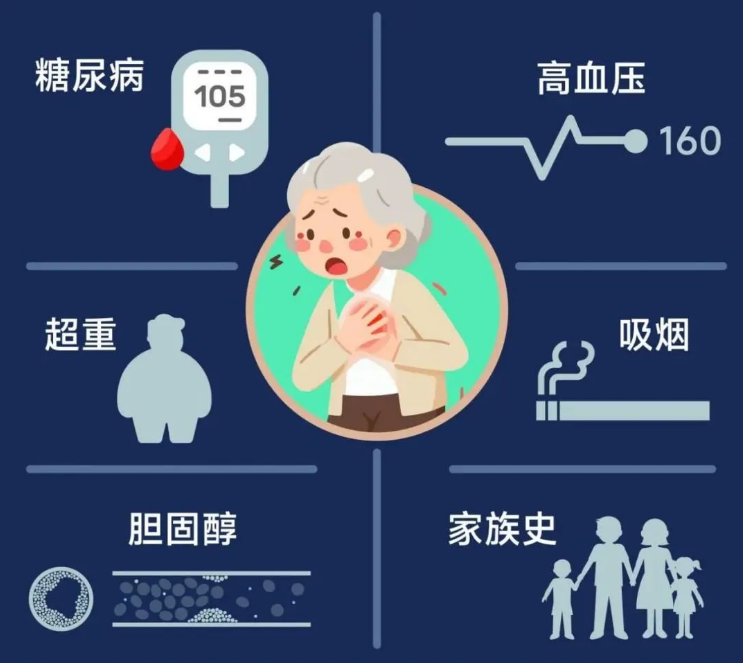
心臟病會引發多種身體并發癥:
1. 心力衰竭:心臟無力把足夠的血液送到身體其他器官,從而導致身體缺血而出現疲勞、氣短、頭暈等癥狀。
2. 心律失常:心臟的跳動出現異常,如心動過緩、心動過速等,可能會出現頭暈、呼吸困難等癥狀。
3. 心肌梗死:心肌缺血,可能會導致猝死。
4. 心臟瓣膜病變:瓣膜受損,可能會導致膿毒性心內膜炎、心肌炎、心律失常等癥狀。
5. 心肌病:心肌細胞受到損傷,可能會導致心率失常、心悸、氣短等癥狀。
然而,傳統療法如藥物治療和手術干預雖然能夠緩解癥狀,但受限于無法從根源修復受損心臟組織。心肌細胞的有限再生能力,使得受損心臟容易經歷纖維化過程,形成功能有限的疤痕組織,導致長期功能障礙。
02《Nature》外泌體為心肌再生提供新策略

2025年《Nature》首次揭示:間充質干細胞(MSC)分泌的細胞外囊泡(30-150nm 外泌體)通過其攜帶的127種生物活性分子激活心肌祖細胞的內源性再生程序;重構梗死區微環境;誘導功能性血管網絡重建來促進心肌再生。
03外泌體:修復心臟的三大機制
外泌體是一類直徑約為30-150納米的微小囊泡,由多種細胞類型分泌,其中包含特定的蛋白質、脂質、細胞因子以及遺傳信息。不同組織來源的外泌體不僅展示出獨特的蛋白分子特征,還攜帶著關鍵分子以執行其功能。隨著研究的深入,外泌體在心血管系統中的臨床應用研究中展現巨大潛力。

促進血管生成,重建供血網絡
受損的心臟組織最直接的問題是供血不足,而血管生成是修復的關鍵步驟。
血管新生是指新的微血管形成并發展成血液供應系統的生理過程。主要涉及血管內皮細胞的活化、增殖和遷移以及血管基底膜的降解。
研究表明,外泌體中富含多種促進血管生成的因子,如血管內皮生長因子(VEGF)和成纖維細胞生長因子(FGF)。這些因子通過激活內皮細胞增殖和遷移,在缺血區域形成新的微血管網絡,恢復心肌組織的血液供應。
近日,復旦大學基礎醫學學院的研究者發現iPSCs衍生的外泌體能改善血清外泌體成分,能提高腎臟、皮膚、大腦、肌肉和肺組織的總抗氧化能力,降低衰老標志物的表達,增加主動脈環的血管生成。

此外,有研究數據顯示,在動物實驗中,外泌體治療能夠顯著提高心肌梗死模型的毛細血管密度,血流恢復率高達80%以上,為受損心肌提供持續的氧氣和營養。
抗炎抗氧化,保護心肌細胞
心臟損傷通常伴隨著劇烈的炎癥反應和氧化應激,這會加速心肌細胞的死亡。
外泌體通過釋放抗炎因子(如IL-10)和抗氧化分子(如谷胱甘肽),有效降低炎癥水平,減少自由基對心肌細胞的破壞。此外,外泌體還能調節巨噬細胞的行為,促使其向修復型(M2型)轉化,加速炎癥消退。
一項涉及20例心肌梗死患者的臨床研究表明,接受外泌體注射后,其炎癥標志物水平下降了40%,心功能指標顯著改善。
由阿拉巴馬大學伯明翰分校、同濟大學和巴黎大學的科學家聯合開展,并在《科學轉化醫學》雜志上發表。研究標題為“Exosomes secreted by hiPSC-derived cardiac cells improve recovery from myocardial infarction in swine”,該研究可能為心肌損傷提供了一種全新的外泌體治療策略。

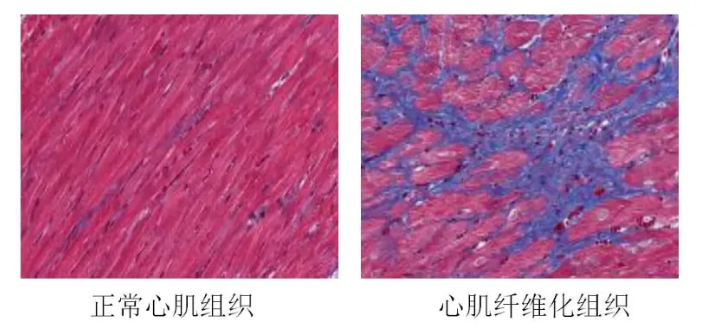
減少心肌纖維化,恢復心臟彈性??
受損心臟在修復過程中容易形成大量纖維化組織,這種疤痕組織缺乏收縮功能,會嚴重影響心臟泵血能力。外泌體通過攜帶特定的miRNA(如miR-21和miR-29),能夠抑制成纖維細胞的過度活化,減少膠原蛋白的沉積,從而減輕纖維化程度。
近年來,外泌體作為細胞間通訊的關鍵介質,在心臟修復領域展現出重要潛力。研究表明,外泌體通過調控心肌細胞、促血管新生、抗纖維化及抗炎反應,從而改善心肌缺血、心肌梗死等心臟損傷。基于外泌體的無細胞療法為心臟再生醫學提供了創新方向,未來有望成為心血管疾病治療的全新突破點。
【資料來源】https://mp.weixin.qq.com/s/KHmrMh1UXLXCsTd-bx93OQ