鄭州源創基因科技有限公司成立于2016年,由哥倫比亞大學博士后趙輝,歸國創辦的國家高新技術企業。擁有97項知識產權及實用技術,業務遍布上海、重慶、深圳、北京等城市,總部在鄭州航空港區。
隨著我國人口老齡化日趨加重,骨質疏松癥這類讓骨骼變脆、容易骨折的“隱形殺手”,正逐漸成為影響中老年人健康的重要問題。人們普遍認為骨質疏松是因為“缺鈣”,于是大量補鈣、曬太陽、喝牛奶,然而效果卻常常不能盡如人意。難道問題真的只是“鈣”不夠嗎?
近日,中山大學附屬第八醫院的科研團隊在國際期刊《Cell Death Discovery》上發表了一項重磅研究,首次從干細胞的角度揭示了骨質疏松的深層次機制。他們指出,骨髓中的干細胞失衡,才是導致骨質疏松的重要原因。

干細胞“走錯路”,骨頭變得越來越脆
我們的骨頭并不是一成不變的,它其實每天都在“拆舊建新”。支撐這種循環更新的,是存在于骨髓中的一類“萬能細胞”——骨髓間充質干細胞(BM-MSCs)。正常情況下,它們會分化為骨細胞,參與骨骼修復與重建。
但研究發現,在骨質疏松癥患者體內,這些干細胞卻偏離了原本的“職業路線”。它們不再安心“修建骨頭”,反而更傾向于變成脂肪細胞,導致骨髓里脂肪越來越多,骨結構卻越來越薄弱。
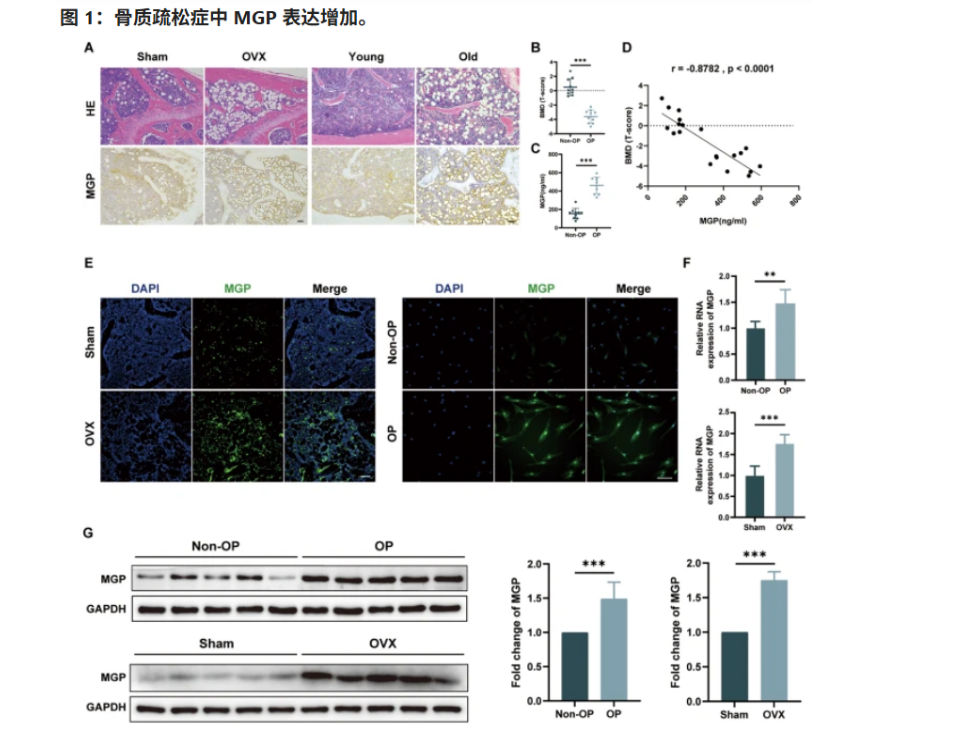
為了驗證這一現象,研究團隊特地招募了多名骨質疏松患者(OP)與同樣人數的健康對照者(Non-OP),深入對比了兩組人群的BM-MSCs分化行為,結果非常明確:骨質疏松人群的干細胞存在顯著的“偏差”,更容易向脂肪方向發展。
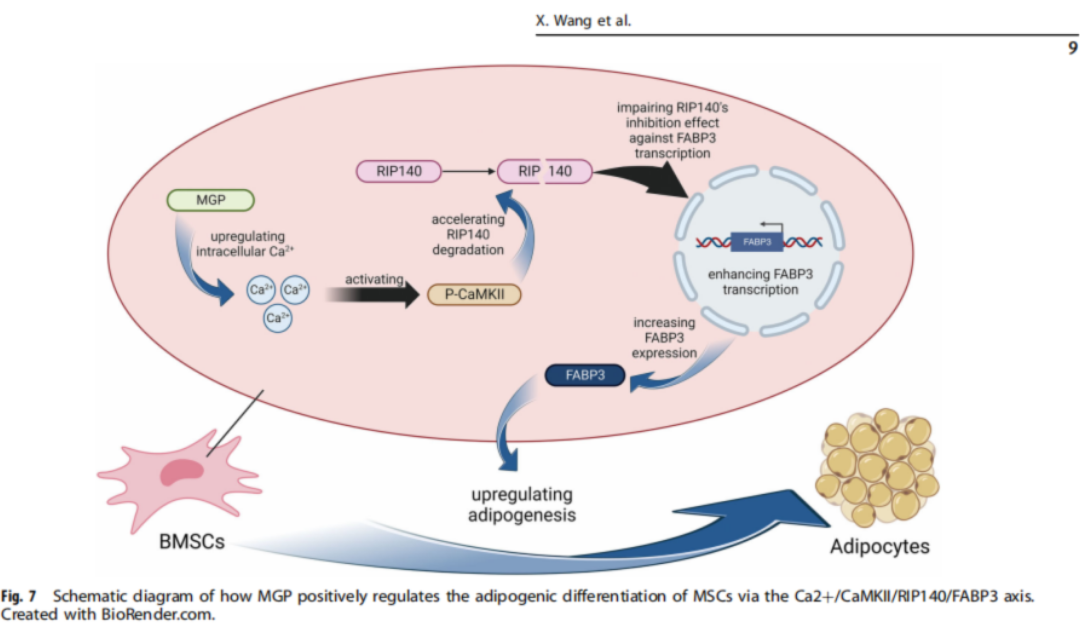
MGP蛋白:干細胞命運的“操盤手”
是什么在操控干細胞的“職業選擇”?研究的重點落在了一種名叫MGP(基質Gla蛋白)的分子上。
研究發現,在骨質疏松人群中,MGP的表達水平顯著升高。這個看似不起眼的小分子,其實在細胞內部起著關鍵作用。它能調節細胞內的鈣離子濃度,一旦水平升高,就會觸發一系列連鎖反應,包括激活CaMKII信號通路,進一步促使一種名為RIP140的抑脂蛋白降解,最終讓FABP3等脂肪生成相關基因被“放開手腳”。
通俗來說,MGP就像一個“指揮官”,它決定了干細胞是去“修骨”還是“長脂肪”。MGP過度活躍,就相當于在干細胞耳邊大喊:“別修骨了,來造脂肪吧!”
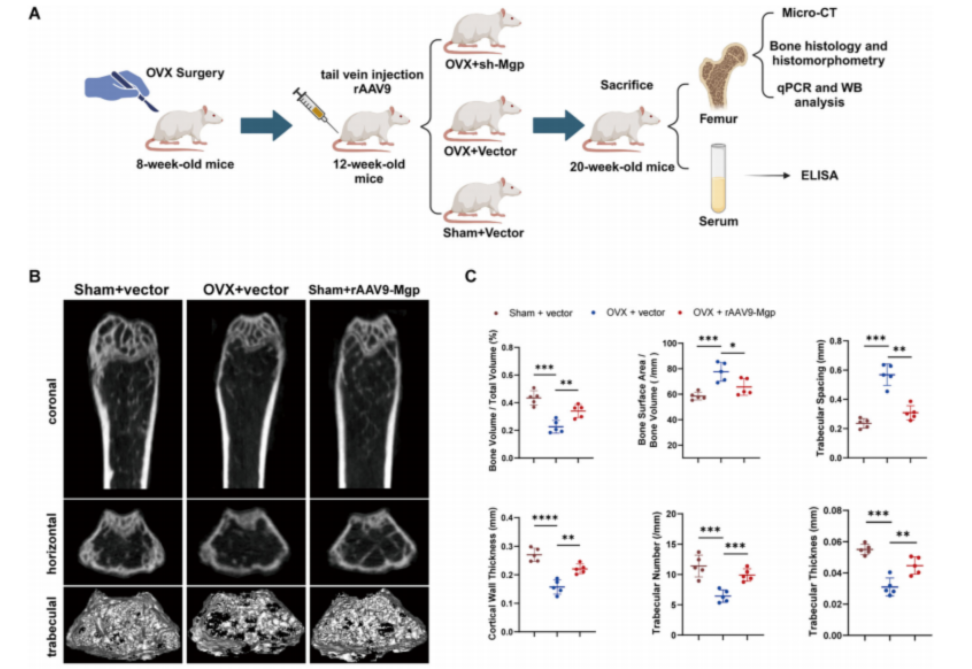
動物實驗證實:調控MGP,骨骼變強了!
理論聽起來不錯,那實踐效果如何?科研團隊選擇了骨質疏松動物模型進行實驗證明。
他們使用一種基因操作工具——重組腺相關病毒rAAV9,成功抑制了實驗小鼠體內的MGP表達。結果令人振奮:小鼠的骨密度顯著提升,骨髓中脂肪細胞減少,骨組織結構也得到了明顯改善。
這一成果表明,通過精準干預MGP等關鍵分子,或許能夠扭轉干細胞的分化方向,讓它們重新回到“造骨”的軌道上,從根源改善骨質疏松!
展望未來:從實驗室走向臨床的關鍵一步
這項研究為骨質疏松的治療打開了一扇新窗。傳統方法多是“治標”——補鈣、激素、抑制骨吸收等,但如果從干細胞“造骨能力”本身出發,精準干預分化過程,我們就有機會走向真正的“治本”。
當然,從動物實驗到臨床應用,還需經歷安全性驗證、藥物開發、治療路徑優化等多個階段。但可以預見,干細胞與細胞療法將在未來醫學中扮演越來越關鍵的角色。
總而言之,《Cell Death Discovery》上發表的這項研究,為骨質疏松癥的治療提供了全新的思路。未來,若能將這種基因干預技術與現有的治療方法相結合,就有可能開發出副作用更小、療效更持久的新藥,為廣大骨質疏松癥患者重塑健康骨骼鋪平道路。
【文獻來源】Wang, X., Zhang, Y., Xu, C. et al. MGP regulates the adipogenic differentiation of mesenchymal stem cells in osteoporosis via the Ca2+/CaMKII/RIP140/FABP3 axis. Cell Death Discov. 11, 166 (2025). https://doi.org/10.1038/s41420-025-02472-2