鄭州源創(chuàng)基因科技有限公司成立于2016年,由哥倫比亞大學(xué)博士后趙輝,歸國(guó)創(chuàng)辦的國(guó)家高新技術(shù)企業(yè)。擁有97項(xiàng)知識(shí)產(chǎn)權(quán)及實(shí)用技術(shù),業(yè)務(wù)遍布上海、重慶、深圳、北京等城市,總部在鄭州航空港區(qū)。
項(xiàng)目信息:
目前一項(xiàng)“腫瘤多肽池誘導(dǎo)的DC-CTL治療實(shí)體瘤的臨床研究”正在全國(guó)多家醫(yī)院開展,觀察腫瘤多肽誘導(dǎo)的DC-CTL細(xì)胞聯(lián)合診斷為Ⅳ期、初治且HLA-A*02陽(yáng)性需進(jìn)行常規(guī)一線標(biāo)準(zhǔn)治療(不限制治療方案)的結(jié)直腸癌、食管癌、肺癌、肝癌、乳腺癌等實(shí)體瘤患者的安全性及初步療效。
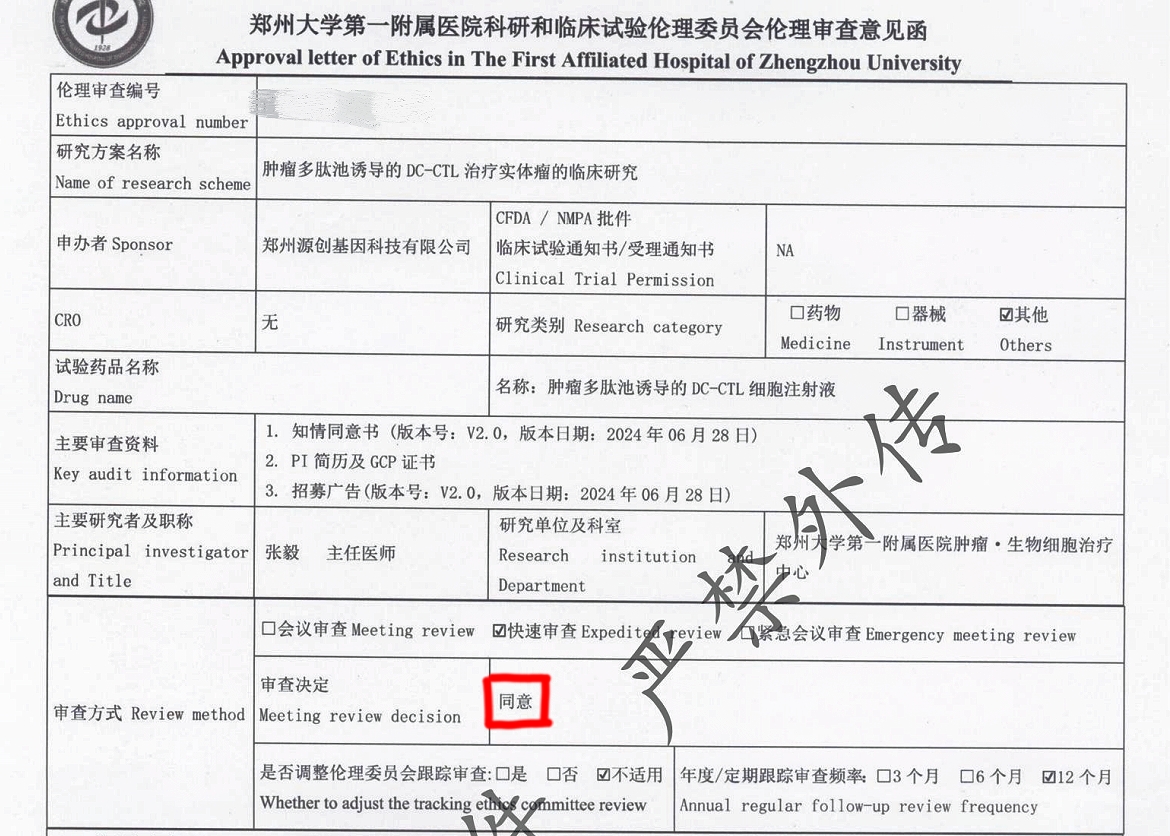
本研究已經(jīng)通過鄭州大學(xué)第一附屬醫(yī)院倫理委員會(huì)審批,計(jì)劃招募20-200例患者。
1DC-CTL細(xì)胞療法介紹
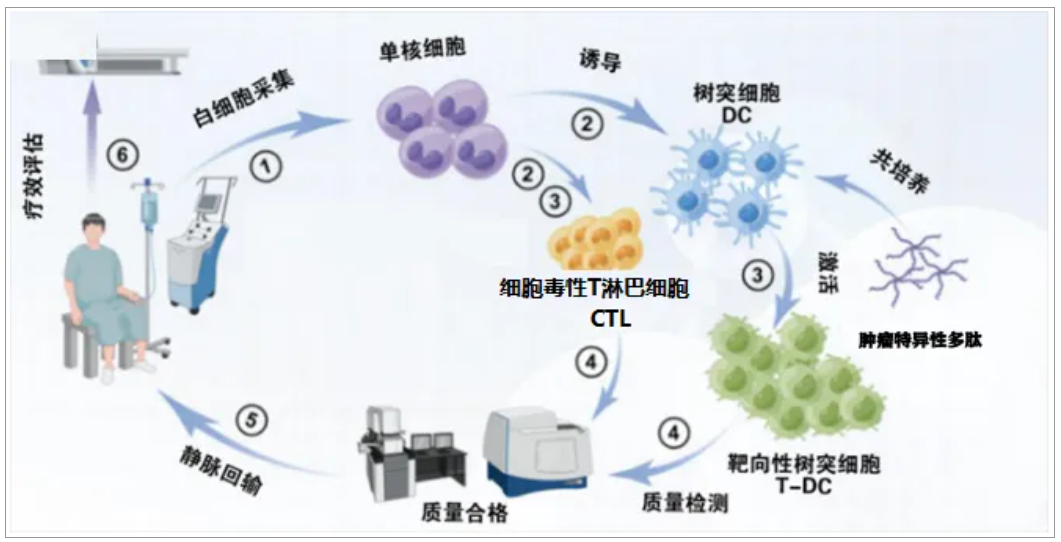
本項(xiàng)目是由源創(chuàng)基因與鄭州大學(xué)生命科學(xué)院強(qiáng)強(qiáng)聯(lián)合,開展的基于特異性多肽池的腫瘤精準(zhǔn)個(gè)性化免疫治療應(yīng)用研究,目前研究團(tuán)隊(duì)已篩選出156種常見腫瘤特異性抗原,鑒定出900余條多肽,具有廣泛的適用性和精準(zhǔn)靶向性。源創(chuàng)基因是由歸國(guó)學(xué)者趙輝博士創(chuàng)辦的專注于體細(xì)胞治療精準(zhǔn)個(gè)性化轉(zhuǎn)化應(yīng)用的國(guó)家高新技術(shù)企業(yè),集科研開發(fā)、臨床試驗(yàn)、市場(chǎng)應(yīng)用為一體,為科研機(jī)構(gòu)、醫(yī)療及健康管理機(jī)構(gòu)、專業(yè)生物醫(yī)藥公司、保險(xiǎn)和銀行等各類行業(yè)客戶提供從技術(shù)開發(fā)到臨床應(yīng)用的全流程細(xì)胞治療相關(guān)技術(shù)服務(wù),特別是在腫瘤免疫治療領(lǐng)域具有深厚的研究積累。該項(xiàng)目腫瘤多肽池誘導(dǎo)的DC-CTL細(xì)胞治療過程如下:
2研究者信息
本研究由鄭州大學(xué)第一附屬醫(yī)院生物細(xì)胞治療中心/生物免疫治療病區(qū)張毅主任醫(yī)師團(tuán)隊(duì)負(fù)責(zé)開展實(shí)施,該科室是集臨床工作、科學(xué)研究、成果轉(zhuǎn)化和精準(zhǔn)臨床檢測(cè)為一體的綜合性科室,擁有專業(yè)的生物免疫治療病區(qū)及省部共建食管癌防治國(guó)家重點(diǎn)實(shí)驗(yàn)室、河南省腫瘤免疫與生物治療國(guó)際聯(lián)合實(shí)驗(yàn)室等研究平臺(tái)。
3本研究患者入選標(biāo)準(zhǔn)
1. 年齡≥18歲,性別不限;
2. 根據(jù)臨床TNM分期診斷為:Ⅳ期,初治且HLA-A*02陽(yáng)性需要進(jìn)行常規(guī)一線標(biāo)準(zhǔn)治療(不限制治療方案)的結(jié)直腸癌、食管癌、肺癌、肝癌、乳腺癌等實(shí)體瘤患者;
3. KPS評(píng)分≥80分,預(yù)期生存期≥3個(gè)月;
4. 若有影像學(xué)可測(cè)量目標(biāo)病灶,普通CT或MRI≥10 mm,淋巴結(jié)短徑≥15mm;
5. 無(wú)其他惡性腫瘤病史,已治愈的原位癌、甲狀腺乳頭狀癌除外;
6. 研究參與者同意參加此項(xiàng)臨床研究,并簽署《知情同意書》。
4本研究患者排除標(biāo)準(zhǔn)
1. 妊娠期或哺乳期婦女(育齡期女性需做妊娠檢查);
2. 患有慢性活動(dòng)性肝炎、艾滋病或梅毒;
3. 患有嚴(yán)重的自身免疫疾病或者免疫缺陷疾病(如系統(tǒng)性紅斑狼瘡、炎癥性腸病、多發(fā)性硬化癥、類風(fēng)濕性關(guān)節(jié)炎、牛皮癬);
4. 嚴(yán)重過敏體質(zhì);
5. 嚴(yán)重精神障礙性疾病;
6. 患有嚴(yán)重心、肝、腎功能不全、嚴(yán)重?zé)o法控制的糖尿病等其他疾病者;
7. 既往經(jīng)過其他基因產(chǎn)物治療者;
5參加本研究的受試者將獲得
1. 免費(fèi)獲得HLA-A*02、腫瘤多肽驗(yàn)證及腫瘤相關(guān)抗原檢測(cè);
2. 免費(fèi)獲得腫瘤多肽誘導(dǎo)的DC-CTL細(xì)胞;
3. 免費(fèi)獲得免費(fèi)提供影像學(xué)檢查、腫瘤標(biāo)志檢測(cè)、免疫功能測(cè)定檢查;
4. 臨床研究保險(xiǎn);
5. 專家定期的隨訪、監(jiān)測(cè);
6. 一定的交通補(bǔ)助及營(yíng)養(yǎng)補(bǔ)貼。
6聯(lián)系方式:400-068-7011